鲜食葡萄栽培岗
王倩兰 陶建敏
摘 要:花青苷在果树作物着色中起到重要的作用。葡萄(Vitis vinifera )中,有一类葡萄不仅可以在果皮中积累花青苷,也可以在果肉中积累花青苷,这类葡萄被称为红肉葡萄。本研究以红肉葡萄新种质钟山红玉(ZS-HY)作为材料,利用RNA-seq及高效液相色谱-质谱(HPLC-MS)技术研究葡萄果实中花青苷生物合成机理。本次研究中,分别在花后3天(3DAA)、花后6天(6 DAA)以及花后22天(22 DAA)进行采样。检测花青苷的组成与含量来验证相关基因的表达水平。其中,在6 DAA时,三羟基取代(飞燕草素、矮牵牛素、锦葵色素-)花青苷的含量远高于二羟基取代(矢车菊素、芍药素-)花青苷。转录组分析后,三个比较组,6 DAA vs 3 DAA、22 DAA vs 6 DAA、22 DAA vs 3 DAA,共检测出3727~5936个差异表达基因(DEGs)。结果分析后,共检测出56个目的基因,包括30个结构基因和26个调节基因,可能与花青苷生物合成相关。在KEGG通路分析中,110个通路中光合作用-天线蛋白(photosynthesis - antenna proteins)和光合作用(photosynthesis)两个通路显著富集,且本次研究提出了光响应对于红肉葡萄的调节假定机制。本次研究第一次在红肉葡萄中进行转录组测序分析,为进一步研究提供理论依据,有助于培育高品质的红肉葡萄。
关键词:花青苷、RNA-seq、红肉葡萄、生长发育、R2R3-MYB
葡萄(Vitis vinifera )是全球广泛栽培的水果作物以及最具经济效益的作物之一。根据粮食和农业组织公布的数据,2016年世界经济葡萄产值超过7700万吨(FAOSTAThttp://faostat.fao.org/)。由于人们对果实品质及外观需求的不断增加,越来越多的研究报道着力于改善果实品质。
花青苷广泛存在于植物界中,是一类显色的水溶性色素物质。在葡萄果实中,花青苷通常只在果皮中存在,而在一类称作红肉葡萄的品种中(Guan et al., 2012),其果肉中也有花青苷的积累。由于在红肉葡萄中含有的高浓度花青苷物质,这类葡萄通常具有很高的营养和药理作用(Monrad etal., 2010),另外由于具有很深的色素以及高水平的单宁物质,红肉葡萄对葡萄酒酿造也有一定的影响(Richardson et al., 2008)。红肉葡萄品种通常在不同的植物组织中都有花青苷的积累,例如果实、茎、叶、芽和种子等(Guan et al., 2012;Falginella et al., 2012)。而大多数的花青苷仍然积累在葡萄果实中,因此许多研究都在探索红肉葡萄品种与果实中的花青苷积累之间的遗传代谢关系(Santiago et al., 2008;Castillo-Munoz et al., 2009)。
花青苷主要使红色葡萄品种尤其是红肉葡萄品种呈现出红色或者紫色。由于红肉葡萄果粒较小、糖分含量较低且颜色较深,通常被用来提高葡萄酒的颜色强度及品质。现有的研究报道主要关于红肉葡萄果肉和果皮中花青苷组分含量的不同,例如一个中国的红肉酿酒葡萄品种‘烟73’,其果皮中含有较多的飞燕草素-、矮牵牛素-、锦葵色素-类花青苷衍生物,而果肉中则含有较多的矢车菊素-、芍药素-类花青苷衍生物(He et al., 2010)。Xie等(2015)研究发现‘ 烟73’ 果肉中OMT(O-methyltransferase),F3’5’H(flavonoid 3’5’-hydroxylase)以及LDOX (leucoantho-cyanidindioxygenase)基因的组织特异性表达可能是造成花青苷组织特异性分布的原因。但是对于红肉葡萄果肉颜色变化相关的分子机制研究远远不够,本次研究第一次利用转录组图谱分析红肉红肉葡萄中的果肉转色机制。
花青苷是植物体内的次级代谢产物,属于类黄酮类物质,通常以糖苷的形式存在于植物液泡中。植物花青苷的生物合成主要由结构基因和调节基因控制,调节下游各个结构酶形成的多种酶复合物,进而催化花青苷合成(Zhao and Dixon,2010)。花青苷合成途径中的结构酶主要包含苯丙氨酸氨裂解酶(phenylalanine ammonia-lyase,PAL),查尔酮合成酶(chalconesynthase,CHS),查尔酮异构酶(chalcone isomerase,CHI),黄烷酮3 - 羟化酶( f l a v a n o n e3 - h y d r o x y l a s e , F3H) , 类黄酮3 ' - 羟化酶( f l a v o n o i d3 ’ - h y d r o x y l a s e , F3 'H) ,类黄酮3 ' 5 ' -羟化酶(flavonoid3’5’-hydroxylase,F3'5'H),二氢黄酮醇4-还原酶(dihydroflavonol4 - r e d u c t a s e ,DFR) , 无色花青素双加氧酶( l e u c o a n t h o -cyanidin dioxygenase,LDOX),UDP-葡萄糖- 黄酮类3 - O - 葡萄糖基转移酶( U D P - g l u c o s e -flavonoid 3-O-glucosyltransferase,U F G T ) 和O - 甲基转移酶(O-methyltransferase,OMT)(Zhao et al., 2016)。在这些结构基因中,PAL 基因与花青苷合成之间的关系尚不明确,因为PAL主要在前期的类黄酮物质合成途径中起作用,而花青苷仅属于类黄酮类物质的一小部分(Lister etal., 1996),而CHS 基因则与花青苷的水平呈正相关(Zhao et al.,2016)。研究发现,F3’5’H 基因的表达水平与石榴果肉中花青苷的含量显著相关(Guan et al.,2016)。在花青苷物质降低的马铃薯突变体中,F3Hs 基因的转基因马铃薯的花青苷水平增加至野生型水平(Maloney et al., 2014)。转录因子家族R2R3-MYB、bHLH(basic helix-loop-helix)和WD40蛋白调节下游的结构基因,参与调控花青苷的生物合成过程。研究报道,R2R3-MYB转录因子可以影响苹果(Umemura et al., 2013;Chagné et al., 2007)、杨梅(Niuet al., 2010)、梨(Li et al., 2012)和葡萄(Cardoso et al., 2012)等作物中的花青苷合成。研究发现,在一个白色葡萄品种‘Italia’中,VvmybA1a 基因有一个反转录转座子Gret1插入,导致其果皮无法合成花青苷,而在其他红色葡萄品种中可以正常检测到VvmybA1 ,说明葡萄中VvmybA1 基因中插入反转录转座子可以导致葡萄白色突变(Kobayashi et al., 2004)。

环境因素如光照等,也能够诱导花青苷的生物合成(Jackson andLombard, 1993)。关于‘烟73’的研究发现,遮光处理下葡萄果肉和果皮中的花青苷含量减少且合成延迟(Guan etal.,2014)。另外,光质如紫外光、蓝光、红光,也会影响花青苷的合成(Peng et al., 2013;Liu et al., 2018),尤其是蓝光被认为是调节花青苷生物合成的主要光线。水果中吸收蓝光的主要为主要由隐花色素(CRY)和向光素(PHOT),而对红光和远红光响应的则为光敏色素(PHY),光响应过程的下游基因,如COP1 、HY5等介导这些光感受器来调控花青苷的生物合成(Liu et al., 2018)。
RNA-seq是一种高效且功能强大的转录组分析工具,包括深度测序技术,可产生数百万的cDANreads。在一些颜色突变水果中,RNA-seq分析用于找出黄皮苹果突变体‘Bolondee’以及其红皮亲本‘Gala’花青苷合成的分子机制,发现其中有34个与花青苷合成相关的基因,最终发现转录因子MdMYB10的突变造成了这一突变现象的发生(El-Sharkawy et al.,2015)。
本研究使用RNA-seq技术,阐明在转录水平上控制葡萄果肉着色的分子机理。此外,对材料中花青苷物质及含量的分析,有助于更好的理解红肉葡萄呈色机制。这一研究有助于后续对葡萄果肉着色相关基因的筛选工作,并对未来葡萄育种及栽培提供理论基础。
1 材料与方法
1.1 材料
1.1.1 试验材料
供试材料同第二章1.1.1。
1.1.2 主要试剂
植物总RNA提取试剂盒(除多糖多酚)购买自成都福际公司,TaKaRa反转录试剂盒,TaKaRaSYBR Premix EX TaqTM荧光燃料购买自大连宝生有限公司,RNA酶清除剂购买于北京华越洋公司。
1.1.3 主要仪器
离心机、琼脂糖凝胶电泳仪、One DropTMOD-1000分光仪(ThermoFisher Scienntific, USA)、荧光定量PCR仪(ABI 7300 system)等。
1.2 方法
1.2.1 样品采集
在盛花后3天(3 DAA,果肉转色前,2017年5月18日),盛花6天(6 DAA,果肉转色期,5月21日),盛花后22天(22 DAA,果肉半转色,6月6日)采集果实样品(图3-1),采集的样品装于1.5 ml冻存管中,立即转移至液氮中冻存,带回实验室后,储存于-80℃冰箱中待用。
1.2.2 总RNA提取、cDNA文库的建立及测序
使用3 DAA、6 DAA和22 DAA三个时期的样品进行测序文库构建。采用Foregene 总RNA提取试剂盒(Foregene Co.Ltd,China),根据使用步骤说明,每个时期样品随机取5-10粒果实进行总RNA提取。利用2200 Bioanalyzer(AgilentTechnologies,Inc.,Santa Clara,CA,USA)检查提取出的RNA质量。使用NEBNext®UltraTM RNA文库制备试剂盒(NEB,USA)建立测序文库。根据试剂盒说明书,利用TruSeq PE Cluster Kit v3-cBot-HS(Illumina)在cBot ClusterGeneration System上进行索引编码样本的聚类。在聚类生成后,将已制备好的cDNA文库在IlluminaHiseq平台上测序,生成150 bp的已配对reads。每个样品做两次生物学重复。
1.2.3 葡萄参考基因组比对及基因功能注释
使用HISAT2将已质控过的高质量clean reads与葡萄参考基因组进行比对。另外对于我们的测序数据,基于以下6个数据库进行基因功能注释:Nr(NCBI非冗余蛋白质序列)、Nt(NCBI非冗余核苷酸序列)、Pfam(Proteinfamily),KOG( C l u s t e r s o fOrthologous Groups of proteins),Swiss-Prot(手动注释修订的蛋白质序列数据库),KO(KEGGOrtholog数据库)GO(GeneOntology)。一般情况下,KEGG和GO功能富集注释是转录组分析过程中最常用的功能分类系统。
1.2.4 差异表达基因(DEGs)分析及KEGG、GO富集分析
采用DESeq R package (1.10.1)进行两个样品间的差异表达基因分析。DESeq采用负二项分布来拟合基因的覆盖reads数,对负二项分布的期望和方差进行估计。筛选的差异表达基因的最高表达量达到最低表达量的2倍以上且p值小于等于0.05。另外将FDR <0.01&| log2|≥1设定为显着差异表达的阈值。
GO富集分析参考Yo u n g 等(2010)的方法进行。KEGG数据库(Kanehisa et al., 2007)一般用于从分子水平信息,特别是从基因组测序和其他高通量实验技术下(http://www.genome.jp/kegg/)生成的大规模分子数据集中了解生物系统的高级功能和效用,例如细胞,生物体和生态系统。使用KOBAS(Mao et al., 2005)软件来测试KEGG途径中差异表达基因的统计富集。
1.2.5 花青苷的提取及定性定量分析
称取1 g样品液氮中磨成粉末状,加入10 ml含1%甲酸的甲醇溶液,在40℃下超声40 min,然后在8,000 rpm下离心20 min,收集上清液,沉淀反复浸提3次,合并所有上清待测。
花青苷总含量使用分光光度法测量。分别测量在525 nm及600 nm两个波段下的吸光度,花青苷总含量计算方法为(OD 525 nm – OD 600nm) * 100,每个样品做3次重复。
使用AB SCIEX Triple TOF5600+液质联用仪测定花青苷的组分及相对含量,主要方法参照已报道的研究(Zhang et al., 2016)进行。流动相A为含0.1%甲酸的水溶液, B为乙腈溶液,流速为0.2ml•min-1。流动相洗脱梯度为:0~5min,10%;5~40 min,5~95%;40~50 min,95%;50~52 min,95~10%;52~60 min,10%,进样量为5μl,检测波长为525 nm。使用电喷雾电离(ESI)开启正离子模式,使用N2, 10 L•min-1在300℃条件下干燥气体,离子扫描范围为150~1200 m/z。每个样品进行3次生物学重复。
1.2.6 qRT-PCR分析
随机挑选9个候选基因,利用qRT-PCR技术验证测序结果的可靠性。使用Beacon Designer软件进行引物设计,引物序列见表3-1,以VvACTIN作为内参基因。分别提取3 DAA、6 DAA及22 DAA三个测序样品中的RNA,并用TaKaRa反转录试剂盒合成cDNA。使用荧光PCR仪ABI 7300进行qRT-PCR,每个样品做3次生物学重复。
2 结果与分析
2.1 花青苷的组分和相对含量分析
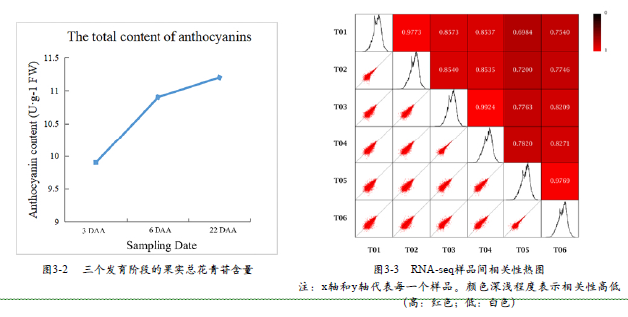
液相色谱-质谱联用(HPLCMS)结果显示,在三个时期中共检测出10种类型的花青苷,其中包括4种酰基化花青素单糖苷和6种非酰基化花青素单糖苷,具体见表3-2。各类花青苷的相对含量用吸收峰面积表示。比较3 DAA,6 DAA和22 DAA之间的花青苷物质含量变化发现,随着果实发育进程,锦葵色素类花青苷衍生物的含量显著增加,而Delphinidin-3-O-monoglucoside的含量则逐渐减少。与此同时,其他种类花青苷,如Peonidin-3-O -monoglucoside,Pelargonidin-3-O-monoglucoside和Cyanidin-3-O-acetylglucoside的相对含量也随着果实发育逐渐增加。另外,本研究利用紫外分光光度计检测3 DAA,6 DAA和22 DAA的总花青苷含量发现,随着果实着色进程,花青苷总含量也不断增加(图3-2)。
2.2 转录本数据结果分析
通过对3 DAA,6 DAA和22DAA三个钟山红玉果实发育时期,共6个样品(每个时期两次生物学重复),进行cDNA文库构建。在去除衔接子序列,包含poly-N和低质量reads后,我们共获取20,000,000 ~ 26,000,000对cleanreads(表3-3)。每个时期样品的两个生物学重复之间的Pearson相关系数大于0.97(图3-3),这说明两个生物学重复之间显著相关,测序结果具有很强的可靠性。
在进行测序结果质控后,用HISAT2将已纯化的数据与葡萄参考基因组(ftp://ftp.ncbi.nlm.nih.gov/genomes/Vitis_vinifera/)进行比对,比对率为92.36% ~ 94.03%,其中每个样品大约有70% reads比对至外显子区,12% ~ 14%比对至基因间区,14% ~ 16%比对至内含子区(表3-4)。
2.3 转录组差异表达分析
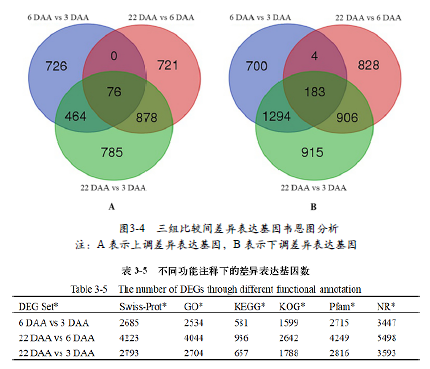
通过对三个果实生长发育阶段进行成对比较,对RNA-seq数据结果分析发现了数千条差异表达基因。在6 DAA vs 3 DAA,22 DAAvs 6 DAA和22 DAA vs 3 DAA三组比较中,共分别检测出3727,3866和5936个差异表达基因(foldchange ≥ 1 or ≤ -1,padj ≤ 0.05)。在22 DAA vs 3 DAA中检测出最多数量的差异表达基因,其中包含2331个上调基因和3605个下调基因,在6DAAvs 3 DAA中分别检测出1373个上调基因和2354个下调基因,而在22 DAA vs 6 DAA中分别检测出1778个上调基因和2088个下调基因。在6 DAA vs 3 DAA和22 DAA vs 6 DAA中包含1131个共同的差异表达基因,而在6 DAA vs3 DAA和22 DAA vs 3 DAA中仅有462个共同的差异表达基因。另外有461个差异表达基因在三组对比中同时出现,其中有182个上调基因和279个下调基因(图3-4)。
2.4 差异表达基因的功能注释及富集分析
本研究中共使用6 种功能注释方法进行差异表达基因的功能注释( 表3 - 5 ) 。比对NR,Pfam,Swiss-Port,KOG,GO和KEGG数据库,在6 DAA vs 3 DAA(22 DAA vs6DAA;22DAAvs3DAA)中分别有3,447(3,593;5,498),2,715(2,816; 4,249),2,685(2,793; 4,223),1,599(1,788; 2,642),2,534(2,704;4,044)和581(657; 936)个差异表达基因被注释。
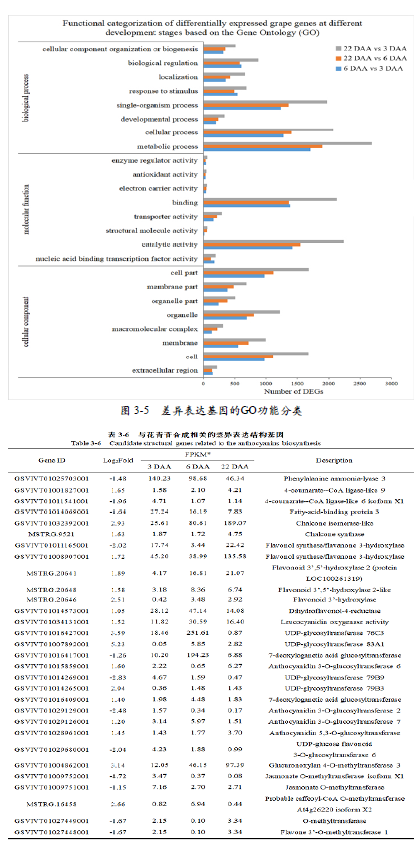
GO富集分析用于预测基因的生物功能,主要分为三类,生物过程(biological process)、分子功能(molecular function)和细胞过程(cellular component)。本研究中, 生物过程功能注释在总的GO分析中占比最大, 达到了46.63%, 其次是细胞过程(31.05%) , 而分子功能则在其中占比最小(22.32%) 。在6 DAA vs 3 DAA,22 DAA vs 6DAA和22 DAA vs 3 DAA三组比较中,代谢过程(metabolicprocess)(24.90%; 1,703, 25.65%;1,895, 24.97%; 2,687),细胞过程(cellular process)(18.65%; 1,275,19.00%; 1,404, 19.22%; 2,068)和单生物过程(single-organismprocess)(18.06%; 1,235, 18.39%;1,359, 18.38%; 1,977)分别是生物过程中最富集的三个亚类,细胞部分(cell part)(23.37%; 975,22.11%; 1,116, 22.68%;1,682),细胞(cell)(23.27%; 971, 22.03%;1,112, 22.63%; 1,678)和细胞器(organelle)(16.56%; 691,15.91%; 803, 16.40%; 1,216)分别是细胞过程中最富集的三个亚类。在6 DAA vs 3 DAA中,催化活性(catalytic activity)(42.72%;1 , 4 2 2 ) , 结合( b i n d i n g )(41.63%; 1,386)和核酸结合转录因子活性(nucleic acid bindingtranscription factor activity)(4.80%;160)是分子功能中最富集的三个亚类,而在22 DAA vs 6DAA和22 DAA vs 3 DAA中,催化活性( 44.78%; 1,550, 43.27%;2,236),结合(39.38%; 1,363,41.15%; 2,126),转运蛋白活性(transporter activity)(6.04%;209, 5.57%; 288)是其中最富集的三个亚类(图3-5)。此外,在GO富集分析中还发现了一些与光响应相关的通路。在6 DAA vs 3 DAA中,从23个与光响应相关的GO通路中发现了97个差异表达基因,其中包含了71个上调基因和26个下调基因。在22 DAA vs 6 DAA中,从20个与光响应相关的GO通路中发现了118个差异表达基因,其中包含了21个上调基因和97个下调基因。在22 DAA vs 3 DAA中,从22个与光响应相关的GO通路中发现了104个差异表达基因,其中包含了33个上调基因和71个下调基因。
基于KEGG数据库,我们对6DAA vs 3 DAA,22 DAA vs 6 DAA和22 DAA vs 3 DAA三组比较间的差异表达基因进行了KEGG富集分析。在6 DAA vs 3 DAA和22 DAAvs 3 DAA两组比较中,碳水化合物代谢(carbohydrate metabolism)是其中最富集的一条通路,分别包含了77和115个差异表达基因,其次富集的通路为能量代谢(energymetabolism),包含了64个(112)差异表达基因; 氨基酸代谢(amino acid metabolism),包含了60个(111)差异表达基因。在22 DAA vs 6 DAA中,最富集的三个KEGG通路分别为,能量代谢、碳水化合物代谢、氨基酸代谢,分别包含了98、71和67个差异表达基因。另外在我们的结果中,光合作用-天线蛋白通路(photosynthesis- antenna proteins pathway)在三组比较中都富集,光合作用通路(photosynthesis pathway)在22DAA vs 6 DAA和22 DAA vs 3 DAA中表现富集。
2.5 目的基因的筛选
2.5.1 参与花青苷生物合成相关目的基因
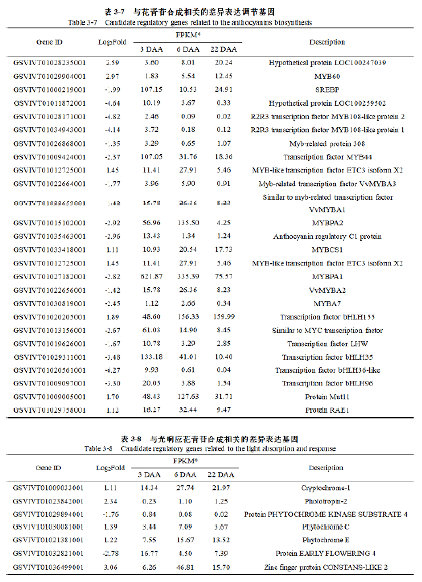
本研究中,共筛选出了56个与花青苷合成相关的差异表达基因,其中包含30个结构基因以及26个调节基因(表3-6;表3-7)。在6 DAA,果肉转色期时,有7个结构基因(表3-6)和6个结构基因(表3-7)表达上调,而后在22DAA表达下调。有5个结构基因和1个调节基因在三个样品时期中,表达量表现为先降后升;8个结构基因和16个调节基因在三个样品时期中,表达量表现持续下降;而10个结构基因和3个调节基因在三个时期中表达量持续上升。一些结构基因,如F3’5’H、F3H、UFGT 和OMT的表达量显著高于其他的结构基因。除此之外,筛选出的26个调节基因,包括18个MYB转录家族因子、6个bHLH转录家族因子和2个WD40蛋白家族因子(表3-7)。
在三个时期实验样品中,4个MYB家族基因和2个WD40转录因子表达先升后降;3个MYB家族基因和1个bHLH家族基因表达持续上升。其中,一些表达上调的调节基因的表达量显著高于其他基因,如GSVIVT01009424001(Myb44 )、GSVIVT01020205001(bHLH155 )和GSVIVT01009005001(putativeWD40)。
2.5.2 参与花青苷合成光响应相关目的基因
本次研究中,在三组比较中共筛选出了20 ~ 23个GO通路以及两条KEGG通路与光响应相关。经过分析发现了7个与光吸收响应相关的目的基因(表3-8),这些基因可能参与调节花青苷合成相关的下游基因。在6 DAA果肉转色期时,有3个光响应相关基因表达上调,包括一个隐花色素相关基因(GSVIVT01009033001)、光敏色素相关基因(GSVIVT01023842001)以及一个注释为bZIP家族COL基因的介导基因(GSVIVT01036499001)。2.6 qRT-PCR验证转录组测序结果随机选取9个目的基因做qRTPCR分析,以验证RNA-seq的准确性和可重复性。在每个样品中,qRT-PCR的结果与RNA-seq分析结果变化趋势一致相关性较高,说明RNA-seq结果准确(图3-6)。
3 讨论
3.1 果实发育过程中的花青苷组分和含量
花青苷通过类黄酮途径合成的一类水溶性色素,对葡萄果实着色有着重要的影响。一般情况下花青苷只在葡萄果皮中积累,但本次研究材料中发现,花青苷积累更早出现在葡萄果肉中。本次研究中,共鉴定出6大类花青苷物质,包括天竺葵素(Pelargonidin,Pg)、飞燕草素(Delphindin,Dp)、锦葵色素(Malvidin,Mv)、矢车菊素(Cyanidin,Cy)、芍药素(Peonidin,Pn)、矮牵牛素(Petunidin,Pt),以及其羟基化和甲基化衍生物(表3-2)。在我们的结果中,检测出来的10种花青苷物质均为单糖苷,这一结果与前人研究报道一致,即在欧亚种葡萄(Vitis vinifera )中主要的花青苷为单糖苷及其衍生物(Cruz etal., 2012),而双糖苷及其衍生物通常在其他中国野生种葡萄中检测到(Liang et al., 2013)。通过比较每种花青苷的吸收峰面积,发现在果肉转色初期,Mv及其衍生物是其中含量最高的花青苷种类,且其相对于其他种类花青苷积累速度更快。Jeong等人(2006)和Noelia等人(2009)都报道过F3’H 基因与F3’5’H基因的表达量比例影响着二羟基取代(Cy-、Pn-)类花青苷与三羟基取代(Dp-、Pt-、Mv-)类花青苷含量的占比。本研究使用花青苷的吸收峰面积来表示花青苷的相对含量,转录组测序以及花青苷测定结果表明,F3’5’H基因的表达量约为F3’H 基因的10倍(表3-6),这与三羟基取代花青苷和二羟基取代花青苷含量之间的比值一致。另外研究结果还发现,一类很难在欧亚种葡萄中检测到的花青苷物质(Boss et al.,2010; Niu et al., 2016),天竺葵素-3-O-葡萄糖苷(Pelargonidin-3-O -monoglucoside)在钟山红玉中也有检测到,说明钟山红玉中可能有着与其他葡萄不同的基因表达模式。
此外,在3 DAA即果肉转色前的葡萄果实中仍然检测到了微量的花青苷物质。近些年,有研究表明一些白色葡萄品种的果皮中也可检测到微量的花青苷(Arapitsas etal., 2015),这可能是受一些可能的UDP-糖基转移酶(UGTs)的影响。在本次研究中,有10个目的基因注释为UGTs,可能参与钟山红玉果实中花青苷的生物合成(图3-7)。
3.2 参与花青苷的生物合成及修饰过程的基因
已有研究报道关于植物花青苷的生物合成途径以及参与其中的关键结构酶基因,帮助更好的理解在许多物种中控制花青苷合成途径的分子机制(Sparvoli et al., 1994; Hanet al., 2012; Jaakola et al., 2002)。
在葡萄(Vitis vinifera )中,对于花青苷的生物合成途径也进行了深入的研究,主要说明葡萄果皮的呈色机制,而对于红肉葡萄果肉呈色的分子机制却很少有报道。苯丙氨酸解氨酶(phenylalaninea m m o n i a - l y a s e ,PAL ) 、肉桂酸- 4 - 羟化酶(cinnamate-4-hydroxylase,C4H)和4-香豆酰-CoA合酶(4-coumaroyl-CoAsynthase,4CL)主要参与从苯丙氨酸到4 - 香豆酰-CoA的苯丙烷类途径, 提供类黄酮途径的前体物。在本次研究中, 只有一个差异表达基因注释为PA L(GSVIVT01025703001),且在3 DAA时表达量最高随后降低(表3-6)。另外,结果显示有两个注释为4CL (GSVIVT01001827001、GSVIVT01011541001)的差异表达基因,但是表达水平较低。PAL(GSVIVT01025703001)基因在果肉转色前表现出高表达,这一基因可能在类黄酮途径的前体物合成中起到关键作用,这一结果也与前人对PAL基因的研究一致(Boss et al., 1996)。类黄酮途径中,查尔酮异构酶(chalconeisomerase,CHI)可以催化从柚皮素查尔酮到柚皮素黄烷酮的过程,这是花青苷生物合成中的关键步骤,在该步骤基础上,花青苷合成途径进入各个分支,合成特异性的花青苷种类。本次实验结果中,共有两个差异表达基因注释为CHI (GSVIVT01014069001、GSVIVT01032392001) 。其中,GSVIVT01014069001随着果实发育进程表达下调, 而GSVIVT01032392001在果实发育过程中(22 DAA)表达显著上调。研究表明,CHI 酶的催化产物在接下来的花青苷合成途径中至关重要,且CHI 基因在葡萄果实膨大期及转色初期表现出很高的表达水平(Silva et la., 2005)。因此,GSVIVT01032392001可能参与钟山红玉果实膨大期及转色期的花青苷合成途径。在转录组测序结果分析中,一个注释为CHS(MSTRG.9521)的新的基因也可能影响果肉的转色。黄烷酮3-羟化酶(F3H )是葡萄基因组中多拷贝基因之一,两个F3Hs 基因(F3H1 和F3H2 )都与黄酮醇的生物合成相关,但是其中只有F3H2 与花青苷生物合成相关。F3Hs 基因可以诱导二氢黄酮醇的合成,据报道F3H2基因在葡萄果实成熟阶段表现出较高的表达水平,这一阶段也是葡萄果皮转色期(Jeong et al., 2008)。
本次研究中,两个目的基因注释为F3H (GSVIVT01011165001、GSVIVT01008907001) , 且GSVIVT01008907001的表达水平在6 DAA和22 DAA两个阶段都表现出现在上升。这说明F3Hs可能在果肉转色中期发挥重要作用,并不是影响红肉葡萄钟山红玉果肉着色的关键基因。类黄酮3’-羟化酶(F3’H)和类黄酮3’5’-羟化酶(F3’5’H)基因属于细胞色素P450家族,通过在类黄酮的B环中3’或3’5’位置催化形成额外的羟基,影响葡萄中二羟基化花青苷以及三羟基化花青苷的比例。因此,F3’H 和F3’5’H 基因将类黄酮途径分成两个分支,一边合成矢车菊素-、芍药素-类花青苷(红色至紫色);另一边合成飞燕草素-、锦葵色素-、矮牵牛素-类花青苷(蓝色至紫色)。Mu等(Muet al., 2014)在‘Yan73’中研究发现,在‘Yan73’果肉中F3’H的mRNA水平显著高于F3’5’H。而在本次研究结果中,F3 ’5 ’H基因的表达水平显著高于F3’H 基因。在基因结构优化后,一些新的基因被发现,其中两个基因注释为F3’5’H (MSTRG.20641、MSTRG.20648),一个注释为F3’H(MSTRG.20646)。在6 DAA vs 3DAA中,F3 ’H 和F3 ’5 ’H 基因的表达水平均增加,且F3 ’5 ’H(MSTRG.20641)的表达水平是F3’H(MSTRG.20646)的10倍,这与花青苷种类含量的结果一致。
因此,F3’5’Hs 可能是钟山红玉果肉转色初期影响其花青苷合成的主要基因。二氢黄酮醇在二氢黄酮醇4-还原酶(DFR)和无色花青素双加氧酶(LDOX)的催化下转化为花青素。在本次研究中,已鉴定出相关差异表达基因注释为DFR(GSVIVT01014573001)和LDOX(GSVIVT01034131001),这一结果与前人研究结果一致(Zhaoand Dixon, 2010; Gutha et al., 2010;Pastore et al., 2011)。
在一系列的生物合成过程后,产生的花青素产物通过糖基化和甲基化修饰形成更加稳定的花青苷结构。在欧亚种葡萄(Vitis vinifera )中,UDP-糖基转移酶(UDPglycosyltranferases,UGTs)可以催化C3位置的糖基化,而在其他物种中还可以催化C5位置的糖基化。VvUFGT 基因是控制葡萄果皮转色的主要基因(Kobayashi etal., 2001; Ageorges et al., 2006)。
但在本次研究中, 只有一个基因(GSVIVT01029680001)被注释为UDP-葡萄糖-黄酮类3-O -葡萄糖基转移酶(UDP-glucoseflavonoid3-O-glucosyltransferase,UFGT ),且在果肉转色期时表达水平无明显上升,这说明UFGT基因可能不是诱导钟山红玉果肉转色的关键基因。有报道指出(Arapitsas et al., 2015; Caputi etal., 2012),在葡萄基因组中鉴定出了181个候选UGT 基因可能参与葡萄转色期时的花青素修饰过程,而在本次研究中,差异表达基因UGTs ,GSVIVT01016427001和GSVIVT01016417001在钟山红玉转色初期时高表达(图3-7)。
这些基因可能参与葡萄果肉中花青苷的积累过程。在葡萄中,单甲基化及二甲基化衍生物占花青苷组成的主要比例。O-甲基转移酶(O-methyltransferases,OMTs ) 是催化花青素C3位置或者C3和C5位置发生甲基化的主要酶。研究表明,V v OMT 1基因在转色期高表达, 通过转录调控影响花青素的甲基化(Costantini et al., 2015; Fournier-Level et al., 2011)。在本次研究中,共有6个目的基因注释为OMT,其中GSVIVT01004862001和MSTRG.16458的表达水平显著高于其他基因(表3-6)。因此,GSVIVT01004862001可能在钟山红玉花青苷甲基化过程中发挥重要作用。
3.3 参与花青苷生物合成过程中的调节基因
参与葡萄花青苷合成过程的主要转录调节因子为R2R3-MYB家族、bHLH-MYC家族以及WD40蛋白家族,这些调节基因通过调控花青苷合成过程中的结构基因表达水平来控制花青苷的生物合成。R2R3-MYB转录因子是植物中最富集的MYB转录因子类别。

VvMYBA1 和VvMYBA2 通过调节UFGT 基因的表达来调节花青苷的生物合成。在本次研究中,目的基因中包含18个MYB转录因子(表3-),其中三个基因分别被注释为VvMYBA1(GSVIVT01022659001)、VvMYBA2(GSVIVT01022656001)和VvMYBA3(GSVIVT01022664001)(表3-7)。这三个基因在6 DAAvs 3 DAA中表达上调,而后在22DAA vs 6 DAA中表达下调,这与花青素3-O-葡萄糖基转移酶基因(GSVIVT01029126001)的表达趋势一致。由此可得出,VvMYBA1、VvMYBA2 和VvMYBA3 基因可能在钟山红玉果肉花青苷合成过程中起重要作用。另外,已有研究表明VvMYBPA1 和VvMYBPA2 参与合成原花青素,且在葡萄果实及种子早期发育过程中高表达,随着果实花青苷的积累逐渐下调(Bogset al., 2007; Terrier et al., 2009)。
在本次结果中发现V vMY B PA 1(GSVIVT01027182001) 和VvMYBPA2(GSVIVT01015102001)基因有差异表达。据报道,VvMYB PA1 可以调控VvANR 、VvLAR 、VvANS 以及VvF3’5’H的表达(Bogs et al., 2007; Kuhn etal., 2013)。VvMYBPA1 基因在3DAA中表达量显著高于6 DAA及22DAA,在钟山红玉中可能导致一些结构基因如F3’5’H的上调。
MYB转录因子被认为是调节类黄酮途径结构基因表达的关键因子,与bHLH转录因子及WD40蛋白也有着相互作用(Jaakola,2013)。有研究报道,VvMYC1 参与调节花青苷及原花青素的合成且与不同的MYB因子相互作用,如VvMYB5a 、VvMYB5b 、VvMYBA1/A2(Hichri et al., 2010),而WD40蛋白与bHLH因子相互作用后在细胞核内与MYB因子相互作用(Matus et al., 2010)。转录组测序结果中,目的基因中共鉴定出6个bHLH家族转录因子及2个WD40家族因子(表3-7)。在这些目的基因中,一个bHLH家族转录因子(GSVIVT01020205001)及两个W D 4 0 家族因子( G S V I V T 0 1 0 0 9 0 0 5 0 0 1 、GSVIVT01029758001)在果实转色期,即6 DAA vs 3 DAA中表达上调,而后在22 DAA vs 6 DAA中表达下调。此外,在KEGG功能注释中注释为类似MYC转录因子的基因GSVIVT01013156001,表达趋势与VvMYBPA1 一致。由此我们猜想,GSVIVT01013156001可能与VvMYBPA1 相互作用参与原花青素的合成。
3.4 光响应下的花青苷生物合成调节
Jeong等(2004)对葡萄的研究发现,ABA处理可以促进葡萄果实中花青苷的积累,而遮光处理会抑制葡萄花青苷的合成。许多研究都证明,光对花青苷的生物合成过程有很大的影响(Guanet al.,2014)。另外,光质也影响着花青苷的积累。有研究发现蓝光相较于=红光和远红光对花青苷积累有着更显著的影响(Meng et al., 2004; Liuet al., 2018)。在番茄中,蓝光暴露与CRY1a 基因和花青苷积累有关(Liu et al., 2018),而SlHY5 可以调节CRY1进而调节花青苷的生物合成。在我们的结果中,注释为HY5(GSVIVT01035829001)和COL2(GSVIVT01036499001)的基因均为光响应基因,且调节下游基因表达,如一些结构基因(CHS 、CHI 、F3’H 、F3’5’H ),进而影响花青苷的合成(Zhang et al.,2011)。拟南芥中,光敏色素可以调节植物对红光和远红光的响应,这可能与植物花青苷合成有关(Steinitz et al., 1979)。Kadomura等(2013)研究发现FaPHOT2 的表达可以增加草莓中花青苷的含量。在本次研究中,一个注释为Phototropin-2 (PHOT2 )的目的基因在果肉转色期时表达量升高,可能作为钟山红玉果实中的蓝光受体。
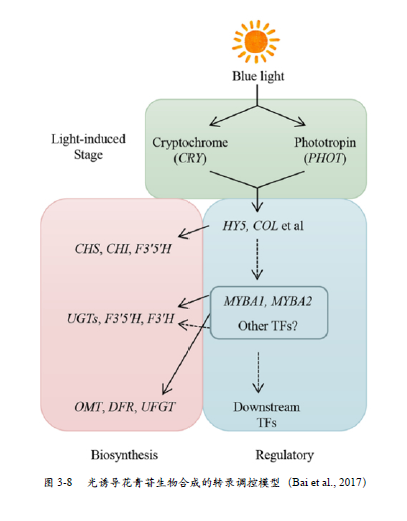
结合B a i 等( 2 0 1 7 ) 对红皮梨遮光处理下的基因表达分析, 推测出一个转录调节模型( 图3 - 8 ) , 可能是红肉葡萄中的光响应反应模式。在葡萄开花后, 果实的光感受器, 如CRY (GSVIVT01009033001)、PHOT (GSVIVT01023842001)等基因接受光照并激活下游HY5(GSVIVT01035829001) 和COL2 (GSVIVT01036499001)基因的转录, 再诱导下游转录因子的表达, 如M Y B A 1(GSVIVT01022659001) 、MYBA2 (GSVIVT01022656001)以及一些结构基因, C H S( M S T R G . 9 5 2 1 ) 、C H I(GSVIVT01032392001) 和F3’5’H(MSTRG.20641)等,最终导致红肉葡萄果肉的转色。