制汁葡萄品种改良岗位
刘倩文 李坤 郭印山 刘镇东 李成祥 郭修武
自毒作用是产生连作障碍最主要的原因之一,因此植物的自毒作用一直受到人们的广泛关注。本研究团队前期对葡萄连作障碍机理进行了比较系统的研究,也证实了化感自毒作用是葡萄连作障碍发生的主要原因之一。并且发现对羟基苯甲酸(4-HBA)作为化感自毒物质,其对葡萄幼苗生长及根系分泌特性具有一定的调控效应。水杨酸(SA)是植物体内普遍存在的一种小分子酚类物质,是重要的能够激活植物过敏反应和系统获得性抗性的内源信号分子,在诱导植物抗病、抗高温、抗盐碱等抗性行程中有十分关键的作用,能在植物体内触发一系列的防御机制,同时可以诱导蛋白质的可逆磷酸化(Mays etal., 2001)。因此,本文以贝达葡萄幼苗为试材,研究4-HBA胁迫下添加外源SA后对葡萄幼苗生长以及抗氧化系统的影响,为进一步明确自毒物质调控葡萄幼苗生长及根系分泌特性的作用机制及缓解自毒效应提供理论和实践参考。
1 材料与方法
此部分试验分为萌发袋试验和水培试验两个部分。
萌发袋试验以贝达葡萄种子为试材。播种后待种子根尖长至2-3mm时进行试验处理,分成2组进行处理。其中1组萌发袋中加入5mL浓度100μmol•L-1 SA,另一组加入等体积的ddH 2O ,预处理3 d 后, 加入不同浓度的4 -HBA进行处理。共设8 个处理, 分别为: 对照(T0) 、5 0 μ g • m L - 1 4-HBA( T 1 ) 、100μ g • m L - 1 4-HBA(T2) 、200μ g • m L - 1 4-HBA(T3) 、100μmol.L-1 SA(SA+T0)、100μ m o l • L -1 SA+50μ g • m L -14-HBA(SA+T1)、100μmol•L-1S A + 1 0 0 μ g • m L - 1 4 - H B A( S A + T 2 ) 、1 0 0 μ m o l • L - 1S A + 5 0 μ g • m L - 1 4 - H B A(SA+T3),连续处理6 d。处理过程中,每隔24 h测量根系伸长量。
每个处理20株幼苗,重复3次。水培试验选以贝达葡萄实生苗为试材。选取饱满的贝达种子,播种在基质中,待幼苗长出5-6片真叶的时候,选择生长健壮且一致的幼苗洗干净根部的泥土后,进行水培处理。先用清水缓苗2 d后,换用1/8的Hoagland’s营养液培养,每2 d更换1次营养液培养,一周后进行试验处理。分成2组进行处理,第一组加入100μmol•L-1SA,第二组加入等体积蒸馏水,采用通气泵通气,处理3 d后,分别加入不同浓度的4-HBA进行共处理。共设8个处理,分别为:0mmol•L-14-HBA(对照)、0.25mmol•L-14-HBA、0.5mmol•L-14-HBA、1 . 0 m m o l • L-14-HBA、100μmol•L-1SA、100μmol•L-1S A + 0 . 2 5 m m o l • L - 1 4-HBA 、100μmol•L-1 SA+0.5mmol•L-14-HBA、100μmol•L-1 SA+1.0mol•L-14-HBA,培养6 d后进行取样。分别取叶片和根系两个部位,用蒸馏水冲洗掉叶片和根系表面的药剂,再用滤纸将表面水分吸干,在液氮中预冷后,置于-80℃保存备用。每个处理3株幼苗,重复3次。
1.2 试验方法
SOD、POD、CAT活性分别用试剂盒法、愈创木酚法和分光光度法测定。丙二醛(MDA)含量用硫代巴比妥酸法测定(汤章城,1999)。 抗坏血酸过氧化物酶(APX)活性用分光光度法测定(Nakano Y et al., 1981)。抗坏血酸(ASA)含量用标准曲线法测定(王泽槐,1994)。谷胱甘肽还原酶(GR)活性用紫外比色法测定(Krivosheeva A et al., 1996)。
1.3 数据统计分析
用Origin9.0和SPSS 19.0进行数据的整理与分析作图,方差分析选用ANOVA过程,采用LSD检验法进行显著性检验。
2 试验结果
2.1 外源SA对4-HBA胁迫下贝达葡萄幼苗根系伸长量的影响
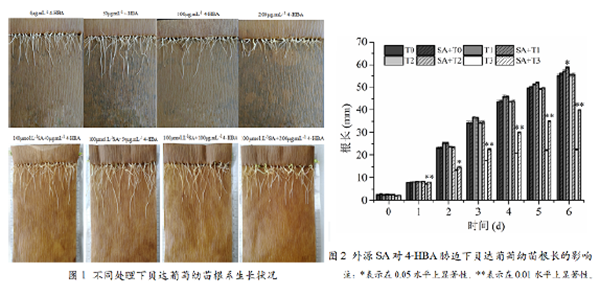
高浓度4 - HBA处理( 2 0 0μmol•L-14-HBA)显著抑制了根系的正常生长,根系长度显著低于对照,且部分根系出现坏死现象。外源SA处理可以缓解高浓度4-HBA对幼苗根系生长的抑制作用(图1)。图2所示为外源SA对4-HBA胁迫下幼苗根系长度的影响。从图2可以看出,处理1 d后,SA处理的根长就显著高于200 μmol•L-14-HBA但单独处理下的根长。随着处理时间的延长,差异逐渐增大。并且根尖的坏死率也得到了明显下降。
2.2 外源SA对4-HBA胁迫下贝达葡萄幼苗MDA含量的影响
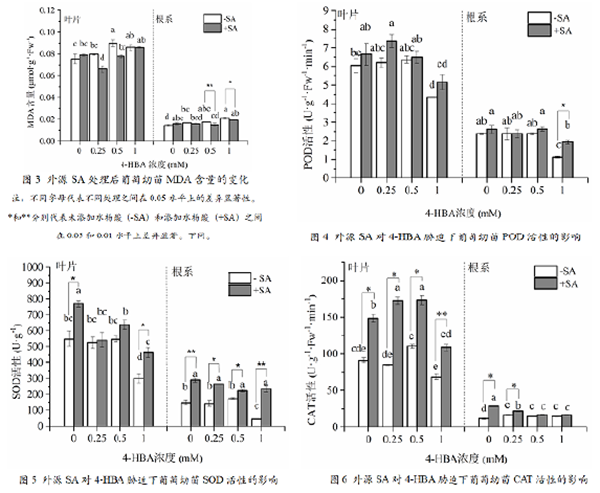
如图3为外源SA处理后,葡萄幼苗丙二醛(MDA) 含量的变化。在叶片中,4-HBA处理后MDA含量显著高于对照。添加100μmol•L-1 SA预处理后,MDA含量有所降低,但差异不显著。在根系中,4-HBA单独处理时,随着4-HBA处理浓度的不断增加,MDA含量逐渐增加,且都显著高于对照。添加SA预处理之后,显著降低了0.5、1.0 mmol•L-1 4-HBA处理下的MDA含量。
2.3 外源SA对4-HBA胁迫下贝达葡萄幼苗抗氧化酶活性的影响
从图4 可以看出,随着4-HBA处理浓度的增加,叶片POD活性呈现先增加后降低的趋势。1 . 0mmol•L-14-HBA处理显著抑制了葡萄幼苗叶片的POD活性,与对照相比降低大约28%。外源SA预处理后,叶片中POD 活性增加,但不显著。相比叶片,根系POD活性整体低于叶片。高浓度4-HBA(1.0 mmol•L-1)处理下,POD活性显著低于对照,降低了54%。其它处理与对照差异不显著。外源SA预处理在不同程度上提高了根系POD活性。与1.0 mmol•L-1 4-HBA处理相比,100 μmol•L-1 SA和1.0mmol•L-1 4-HBA共处理下根系POD活性显著增加了43%。
图5 为不同处理对葡萄幼苗超氧化物歧化酶(SOD)活性的影响。在叶片中,1.0 mmol.L-14-HBA显著抑制了SOD活性,其它处理与对照不显著。100 μmol•L-1SA+1.0 mmol•L-1 4-HBA处理下的SOD活性比1.0 mmol•L-1 4-HBA处理显著增加了51.8%。根系中SOD活性变化比叶片中更明显,与4-HBA单独处理相比,外源SA显著增加了根系SOD活性。
图6为不同处理对葡萄幼苗过氧化氢酶(CAT)活性的影响。叶片中,随着4-HBA处理浓度的增加,CAT活性呈先增加后降低的趋势。外源SA处理显著提高了不同浓度4-HBA单独处理下的叶片CAT活性。根系中CAT活性低于叶片,不同浓度4-HBA处理后根系CAT活性先升高后降低,外源SA处理显著增加了0、0.25 mmol•L-1 4-HBA处理下的CAT活性,增加比例分别为:52.5%和23.2%。
2.4 外源SA对4-HBA胁迫下贝达葡萄幼苗APX和GR活性的影响
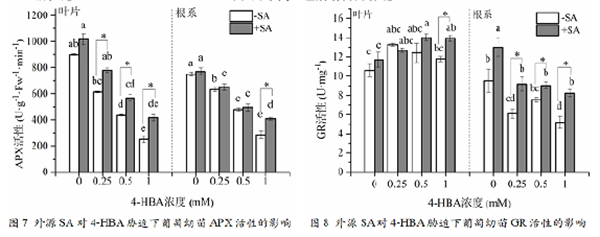
图7为不同处理后幼苗的抗坏血酸过氧化物酶(APX)活性,从图中可以看出,对照中叶片和根系均保持较高的APX活性。不同浓度4-HBA处理后,葡萄幼苗叶片和根系中APX活性均逐渐降低。在叶片中,外源SA预处理后,显著提高了0.25、0.5、1.0 mmol•L-1 4-HBA处理下的APX活性,在根系中,外源SA预处理后,显著提高了1.0 mmol•L-14-HBA处理下的APX活性。
图8为不同处理后幼苗的谷胱甘肽还原酶(GR)活性,从图中可以看出,在叶片中,随着4-HBA
处理浓度的增加,GR活性呈现先增加后降低的趋势,与对照相比差异不显著。外源SA预处理显著提高了1.0 mmol•L-14-HBA处理下的GR活性。在根系中,外源SA预处理显著提高了幼苗根系中不同浓度4-HBA处理下的GR活性,使其在胁迫条件下一直保持着较高的活水平。
3 小结
(1)高浓度4-HBA胁迫对葡萄幼苗的正常生长产生了一系列不良影响。高浓度4-HBA胁迫下,葡萄幼苗根系生长受到显著抑制,根尖发黄坏死,抗氧化酶活性显著降低。
(2)SA处理后可以刺激和诱导细胞内SOD、POD、CAT、GR、APX等抗氧化酶的活性,使其在4-HBA胁迫下保持相对较高的活性,从而清除积累的活性氧,使细胞MDA含量降低,缓解了高浓度自毒物质4-HBA胁迫对葡萄幼苗的伤害作用。