鲜食葡萄栽培岗位
摘 要
休眠是多年生植物生长发育的重要阶段,使植物能够耐受不利的气候条件。基于转录组数据分析,本研究比较了赤霉素(GA)和脱落酸(ABA)相关通路在三个不同休眠阶段的转录本水平,即夏芽(C1),相对休眠(C2)和内休眠(C3)。结果显示,不同休眠阶段GA和ABA信号转录本表达水平显着上调。在C2与C3期间,大多数与蛋白磷酸酶2C(PP2C)相关的转录物表现出下调。在C1与C3中,与PYR / PYL相关的三种转录物上调,而在C2与C3中,只有一种转录物表现出较低转录水平。在C2和C3期间,四个(SnRK2)相关转录物表现出下调。在GA信号通路中编码DELLA蛋白的六个转录物显示C1和C3期间下调,而在C2和C3期间,10个转录物上调。在C1和C3期间,编码GID2蛋白的9个转录物上调,而6个转录物在C1和C3期间分别下调。与其他两个阶段相比,在C3阶段观察到较低的ABA含量,而在C3阶段的GA3含量高于C2阶段。表达分析揭示了ABA和GA信号转导相关的转录物参与休眠机制。基于上述结果,我们推测ABA和GA途径充当调节葡萄芽休眠的调节开关。
1 前言
葡萄(Vi tis v in i f e ra)是最受欢迎的水果作物之一(Denget al.,2016)。目前,中国已成为全球主要的鲜食葡萄生产国,产量约为900万吨(美国农业部,2014年)。芽休眠是大多数多年生植物的典型生理状态,是植物自身在不利环境条件下产生的自我生存保护策略。基于生长抑制作用,休眠可分为三个阶段;相对休眠(PD),内休眠( E D ) , 和生态休眠(ECD)(Lang et al.,1987 )。
引起植物休眠的主要环境条件包括低温和光周期变化(Da SilveiraFalavigna et al.,2014)。休眠在生产上会对葡萄产量产生一定的影响。例如,在温带或亚热带气候地区,由于需要很长时间来打破休眠,因此难以实现高产(Zhenget al.,2015);在冬季气候较温暖的区域,还需要通过使用化学物质来补偿冬季休眠冷量积累才能确保最大产量(Da Silveira Falavigna,2014)
在分子水平上, 芽休眠与MADS-box家族基因密切相关 ,这些基因的调控作用对于桃树的生长停止和休眠建立至关重要(Bielenberg et al.,2008)。前人研究报告评估了基于低温和光周期变化调控休眠的分子模型(Horvath,2009 ; Campoy etal.,2011)。Khalil-Ur-Rehman etal.(2017b)的研究表明,葡萄与其他落叶果树在其整个生长周期有着相似的休眠特性;中国东南部的葡萄芽通常在2月底完成需冷量的积累并在春季开始开花,但在此期间,由于需冷量不足会导致开花不均匀,最终导致产量降低。在木本植物中,RNA的转录组测序已经成为了一种的有效研究手段,并广泛应用于转录组学分析以研究植物的休眠机制。通过转录组学分析简要阐述了假定的激素和光周期调节休眠机制(Zhu et al.,2015)。Annadurai et al.的研究表明,RNAseq在木本植物中比任何其他方法更加有效和精确,以鉴定在分子水平上调节休眠的代谢网络。
杨树的休眠诱导涉及较多代谢和转录过程。这些细胞组分控制冷响应相关蛋白的活性与合成,其主要通过乙烯和ABA通路来调节芽休眠(Ruttink et al.,2007)。在秋季ABA含量增加导致枝条生长停止,促进顶芽的形成及诱导芽进入休眠。杨树生长停止后在其顶芽观察到ABA含量升高,其与ABA生物合成途径相关基因(ABA2, NCED3,和 ABA1)的表达有关( Wang etal.,2016)。有研究表明GA应用可以替代冬季低温积累以打破休眠(Van der Schoot和Rinne,2011)。
在化学处理之前和之后的休眠释放期间,相关文献中并未充分证明GA信号转导和生物合成途径对休眠的调节作用(Gai et al.,2013)。近年来,许多研究学者在ABA和GA生物合成和信号传导途径上做了大量研究,以期揭示果树和其他植物中芽休眠的分子和生理机制(Bai et al.,2013 ; Ueno etal.,2013 ; Zhu et al.,2015 ; Khalil-Ur-Rehman )。Khalil-Ur-Rehmanetal.,2017b 到目前为止,还没有研究报道使用基于转录组学方法来研究葡萄的芽休眠机制。
关于葡萄的芽休眠,国内主要是用不同种类的人工破眠剂对不同葡萄品种进行处理,研究对其休眠解除的影响,但机制方面的研究相对较少,本研究通过使用基于RNA-seq的转录组学分析揭示了葡萄在各休眠阶段的ABA和GA途径的转录谱。目的是为了阐述有关GA和ABA信号通路的转录本表达模式, 以期为葡萄芽休眠的分子和生理机制研究奠定基础。
2 材料与方法
2.1 植物材料
试验在南京农业大学园艺学院侯家塘葡萄基地进行。供试品种为6年生阳光玫瑰,采用H型整形,短梢修剪,常规管理。采集未萌发的夏芽(SB)和未处理的类休眠(PD)时期冬芽以及内休眠芽(ED)三个时期的芽进行实验,将收集的样品立即在液氮中冷冻并保存在-80℃下进行进一步分析
2.2 RNA分离和文库制备
采用RNA提取试剂盒(成都福际生物技术有限公司)提取休眠芽总RNA,操作过程严格按照试剂盒说明书进行。用1%琼脂糖凝胶电泳检测RNA纯度以及完整性,利用Biophotometer检测RNA样品浓度和OD260/OD280的值。委托深圳恒创基因有限公司完成质控、建库,以及用Illumina HISeq™ X Ten进行测序。
2.3 原始数据质量评估与比对分析
通过消除低质量和衔接子序列来过滤原始读数. 通过比对软件HISAT比对到参考基因组上。(http://ftp.ncbi.nlm.nih.gov/genomes/Vitis_vinifera/Assembled_chromosomes/seq/vinifera),最多存在两个碱基不匹配。此外,利用RPKM值分析三个休眠阶段中转录物表达的变化。
2.4 DEG的筛选
运用FPKM(Fragments perkb per million fragments)法计算基因的表达量,依据基因表达量(FPKM值)计算得到不同样品之间基因的差异表达倍数。差异基因筛选的标准为:FDR(FalseDiscovery Rate)≤0.001,同时倍数差异|log2 Fold(CK/CP)|≥1的基因。筛选出差异基因后,进行相关的GO分析和KEGG 通路分析(Wanget al.,2009)(Bland和Altman,1995)。测序后获得的数据保存在NCBI数据库(登录号,GSE77119)中。
2.5 内源激素的测定
内源性ABA和GA的测定参考(Durgbanshiet al.,2005)所提出方法进行。使用纯GA3和ABA作为内标(中国上海Merck公司)。用100%(v / v)甲醇将它们配成1.0mg ml-1的溶液制备内标。对三个休眠阶段的芽样品进行内源激素ABA和GA的测定。
2.6 实时定量PCR(RT-qPCR)
在本研究中,用Primer3软件进行引物设计,而VvActin(登录号XM_010659103 )作为内参基因。如(Khalil-Ur-Rehmanet al.,2017a)所述进行RT-qPCR测定。反应体系参考SYBR® Premix ExTaqTM (TaKaRa, 中国大连)说明书。每个样品设置3个生物学重复。
2.7 统计分析
使用SPSS18.0对数据进行方差分析,以评估不同休眠阶段其激素含量的变化
3 结果
3.1 RNA-Seq文库的分析和注释
在本研究中,对三个不同休眠阶段芽进行转录组分析。从三个RNA-seq文库中获得大约79,642,140个原始读数,删除了1,138,648个低质量读数,获得78,503,492个高质量读数。通过比对软件HISAT比对到葡萄参考基因组(Kim et al.,2015)。
3.2 差异基因表达分析
对三个休眠阶段差异表达基因进行分析。鉴定了具有显著变化的每一个的差异表达基因(倍数变化≥2且p≤0.05)。在三个休眠阶段中,不同的休眠阶段显示在SB与ED之间观察到最大的差异,其导致7596个转录物的下调和2184个转录物的上调。在C2与C3比较中,2969个转录物被上调,5980个转录物被下调,在C1对C2比较中,943个转录物的上调和2995个转录物的下调(图1、表1)。
3.3 休眠阶段的DEG功能分类
为了对DEGs功能进行分类,使用p值≤0.05 进行GO和KEGG分析。根据功能,DEG被分为三个组,即:分子功能,生物过程和细胞组分。如表1所示,GO富集分析显示1477(C2 vs C3),212(C1vs C3)和309(C1 vs C2)个基因在生物过程中富集。在C2 vs C3和C1 vs C2中,DEGs主要富集在“氧化还原过程”和“代谢过程”,而与这些类别相关的大多数转录物高度表达。在C1 vs C3中,DEGs主要富集在“对盐胁迫和生物合成过程的响应”中,并且与这些过程相关的转录本被下调。该分析鉴定了299(C1对C2),1407(C2对C3)和1095(C1对C3)个差异表达基因富集在“分子功能”类。在C1与C3和C2与C3之间,DEG主要富集在“ATP结合”相关代谢过程,并且该类别中的大多数相关转录物在C1对C3中显示出上调,而在C2对C3中分别下调。在C1 vs C2中 鉴定的DEGs与 “蛋白质丝氨酸/苏氨酸激酶活性和金属离子结合”有关,并且与这些相关的大多数转录物被下调。细胞组分类别包含137(C1对C2),1407(C2对C3)和1433(C1对C3)个差异表达基因。在C1与C3和C2与C3中,发现DEGs富集在“膜的整合组分”,其中大多数转录物显示出更高的表达水平。
对三个休眠阶段的KEGG进行分析,即C1对C2,C1对C3和C2对C3(表2)。在C2与C3中,266个基因在“二萜生物合成和植物激素信号转导途径”中被注释和富集,并且与这些途径相关的大多数转录物被上调。在C1与C3中,260个DEG被注释并富集在“苯丙烷类生物合成,核苷酸糖和氨基糖代谢和类黄酮生物合成”过程,其中大多数转录物被下调。在C1与C2中,
247个DEG注释和富集“内质网中的蛋白质加工和植物激素信号转导”过程中,并且显示下调。
3.4 在休眠期间与GA和ABA信号传导相关的基因
在该研究中,在三个不同的休眠阶段分析ABA和GA信号传导途径。在GA信号通路中,44个转录本注释为GID1转录物,其中6个转录物显示下调表达,在C1与C3中,发现与DELLA蛋白家族相关的6个转录物下调。在C2与C3比较中,编码GID2蛋白的9个转录物被上调,在C1和C2中6个转录物被下调(图2))。在ABA信号通路中,14个转录物被注释为PP2C转录物,在C1和C3中6个转录物上调。在C2和C3中注释为SnRK2的一些转录物上调。9个转录本注释为PYR /PYL,其中1个转录本在C2与C3中下调,而2个转录本在C1与C3中下调(图3)。
3.5 休眠阶段的ABA和GA3含量
对三个不同的休眠阶段ABA和GA3含量进行测定。与C1和C3阶段相比,C2阶段ABA含量更高,与C2和C1阶段相比,C3阶段GA3含量更高(图4)。
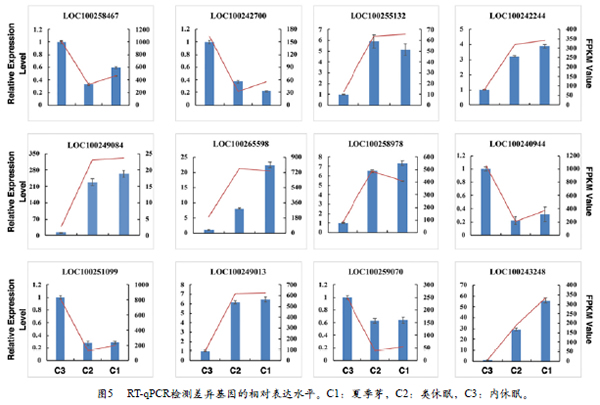
3.6 荧光定量验证差异表达基因
选择与GA和ABA信号传导途径相关的12个DEG用于RT-qPCR分析以验证RNA-seq数据的准确性。对于每个阶段,RT-qPCR结果与转录组学分析确定的转录物表达水平密切相关(图5)。
4 讨论
葡萄是是我国重要的园艺作物。在冬季不利的气候条件下,植物休眠对植物生长起着关键作用。据Kühn et al.(2009)报道,低温和短日照可诱导葡萄芽进入休眠。有大量研究学者对葡萄中芽休眠的分子和生理方面进行了报道(Fennell和Hoover,1991;Sreekantan et al.,2010 )。本研究
使用高通量测序技术对不同休眠阶段的GA和ABA信号通路相关的大量转录本进行分析。发现在夏芽与内休眠,夏芽与相对休眠和相对休眠与内休眠分别共有9780、8975和3983个基因差异表达。前研究表明,基因活动在休眠的初始阶段表达量最低,但在休眠释放时升高(Hedley et al.,2010)。在这项研究中,KEGG数据库显示这些转录本属于各种不同途径。在核糖体,次生代谢生物合成,淀粉和蔗糖代谢, 而苯丙烷类生物合成, 植物激素的信号传导5个途径中, 夏芽与相对休眠和相对休眠与内休眠比较中观察到显著差异, 有关的途径在夏季芽中呈现出对比度。在梨中也有类似的报道( L i u e tal.,2012; Bai etal.,2013),转录组分析显示,在整个休眠周期的5个通路中,甘油磷脂内酯合成、植物-病原菌相互作用、核糖体、代谢途径和内吞作用都存在显著差异。在本研究中, GO的富集在激素代谢和氧化还原过程与先前报道一致(Horvathet al.,2008)。
Regnault et al.(2014)报道,不同组织芽和花的大部分生理生化反应促进了植物激素反应,以保持细胞分裂。ABA和GA在芽和种子休眠以及植物的生长和发育中起主要作用。ABA可对不同生态胁迫做出反应因此被认为是一种重要的激素,其作用主要是促进植物的休眠。(Cooke et al.,2012)。ABA在种子休眠诱导及其维持中也发挥着重要作用(Wen et al.,2016)。在短日照条件下, ABA含量和生物合成相关基因上调(Ruttink et al.,2007)。研究表明,休眠释放与内源性ABA水平降低有关(Horvathet al.,2008)。在这项研究中,在相对休眠阶段 ABA含量较高,本实验结果与Rohde和Bhalerao(2007)研究成果相一致。在ABA信号传导途径中,PP2C基因充当关键调节因子。PP2C基因在休眠期间表现出规律变化。在ABA存在下,最大磷酸酶显示被P Y R / P Y L受体抑制(Park et al.,2009 )。在杨树休眠芽中发现了与ABA信号传导和合成相关的转录物并且其表达量逐渐升高(Ruttink et al.,2007)。在本研究中,基于转录组测序数据分析了不同休眠阶段ABA和GA信号通路对休眠的调节作用。结果显示PYR / PYL在夏芽和内休眠阶段中表达水平上调,而在相对休眠下与内休眠阶段则是下调的。在相对休眠与内休眠中观察到11个上调和5个P P2 C转录本的下调。此外,与ABA相关的转录本在寒冷期显示出下调,这可能是葡萄休眠的必要条件(Mathiason et al.,2009)。这与我们的结果相似,在相对休眠和内休眠中观察到与ABA相关的转录物表达水平的升高,而在夏芽和内休眠中观察到表达水平的降低。
根据之前的研究结果,ABA可能在诱导和维持内休眠中发挥重要作用。在休眠期间,GA被认为在植物休眠中扮演着重要的角色。之前有研究表明,GA水平的提高和GA信号转导是内休眠释放的关键条件(Tamura et al.,1992)。在自然条件下,拟南芥种子发育过程中GA3ox1基因表达降低,而GA2ox2基因表达升高(Footitt et al.人,2011)。该VvGA3ox和VvGA20ox基因在休眠诱导期间表达水平降低,在深度休眠期(endodormancy)期间达最低水平。在拟南芥中,种子萌发主要通过GA信号通路中的GID1受体进行(Voegele et al.,2011)。在三个休眠阶段,这些转录本显示出不同的表达模式,与GID1家族相关的转录物显示出更高的表达,而DELLA家族转录物在三个休眠期显示出较低的表达水平。因此,ABA和GA相关转录本表达谱的变化表明,这两种激素可能在调节葡萄花蕾休眠中发挥不同的作用。
5 结论
由上可知, ABA和GA信号通路在葡萄芽休眠期间可能发挥着重要作用。通过对三个休眠阶段进行转录组测序发现,ABA和GA途径的作用机制在休眠过程中已经变得非常明显。本研究将ABA和GA两种通路联系起来,并对该两条途径相关的基因进行功能验证,由此揭示葡萄芽休眠过程中的分子作用机理。