病毒病防控岗位
胡国君 董雅凤 张尊平 范旭东 任芳
摘 要: 为建立高效的葡萄病毒A(Grapevine virus A, GVA)的检测技术体系,本研究在已报道检测引物GVA-F1/R1内部,分别设计了巢式扩增引物GVA-F2/R2,扩增片段的大小分别为221 bp。对巢式引物的扩增条件进行优化发现,引物GVA-F2/R2的用量(10 mmol/L)为0.3 μL,退火温度为59℃或61℃时,扩增效果最佳。对巢式引物的灵敏度进行测定,结果表明,模板稀释至10-7时,GVA-F2/R2仍能扩增出目标条带。对随机收集的60份葡萄样品中的GVA进行检测发现,巢式引物的检出率为23.3%(14/60),比单一引物GVA-F1/R1(10.0%)、GVA-F2/R2(8.3%)均提高了1倍。
关键词:葡萄病毒A;检测;巢式RT-PCR
皱木复合病在世界范围内的葡萄产区普遍发生,被认为是最具经济危害的葡萄病害之一。该病害是引起葡萄木质部畸形的一类葡萄病害的统称,在葡萄属指示植物沙地葡萄圣乔治、Kober 5BB、LN33上表现沙地葡萄茎痘、kober茎沟、LN33栓皮和LN33茎沟4种类型的症状。研究发现葡萄病毒A(Grapevine virus A, GVA)与kober茎沟的产生有关。GVA属葡萄病毒属(Vitivirus),可通过嫁接传播,在自然条件下也可通过粉蚧传播(duPreez et al., 2011)。栽植无毒繁殖材料是控制病毒病的主要手段,因此,建立一套快速、准确、高效的检测技术对病毒的防控具有重要意义。本研究在分析前人GVA检测方法的基础上,设计了巢式扩增引物,以期提高检测效率和灵敏度,从而为病毒的分子鉴定、脱毒检测等提供技术支持。
1 材料与方法
1.1 材料
供试植物材料:中国农业科学院果树研究所国家落叶果树脱毒中心样品保存圃中收集的60份葡萄样品休眠枝条。
试剂: rT a q DNA聚合酶、dNTPs、克隆载体pMD18-T和大肠杆菌Escherichia coli DH 5α 感受态细胞,宝生物工程(大连)有限公司;琼脂糖凝胶纯化回收试剂盒,北京艾德莱生物科技有限公司;反转录酶M-MLV,Promega生物技术有限公司。
引物:参照GenBank 收录的GVA序列,对比分析已报道的GVA检测引物GVA-F1/R1,在两个引物扩增片段的内部分别设计巢式扩增引物GVA-F2/R2(表1)。
仪器:PCR扩增采用美国伯乐公司生产的Bio-Rad S1000型PCR仪,核酸浓度测定采用美国丹诺尔公司的超微量紫外可见分光光度计DS-11。
1.2 方法
1.2.1 总RNA提取
参照Foissac等(2001)的方法,略有修改。称取0.1 g样品(休眠枝条的韧皮部),加入1mL提取缓冲液研磨;取500 μL匀浆,加入150 μL 10% N-lauroylsarcosine,70°C保温10 min,冰上放置5 min,14,000 r/min离心10 min;吸上清400 μL加入含150 μL无水乙醇、300 μL 6M碘化钠和30 μL 10%二氧化硅悬浮液的混合液中,震荡20min;6000 r/min离心1 min,弃去上清,加入500 μL洗涤缓冲液,6000 r/min离心1 min,洗涤两次后室温风干,重悬浮于DEPC水中,70 °C保温4 min,13,000 r/min离心,取上清保存于-20 °C。
1.2.2 cDNA的合成
取上述总RNA 2μL、6碱基随机引物1μL、DEPC处理去离子水7μL于一离心管中,沸水6min,冰上3min。依次加入:5×RT buffer 2μL、dNTPs(10mmol/l)1μL、M-MLV(200U/μl)0.5μL,用水补足至20μL。混匀后37 °C水浴1h,70 °C灭活5min,冰浴3 min,-20 °C备用。
1.2.3 巢式PCR扩增
第一轮PCR扩增:取上述合成的cDNA 2μL,依次加入10× RCRbuffer 2.5μL、dNTPs(10mmol/L)2μL、同源和互补引物(表1)各0.5μL、 rTaq DNA聚合酶 1 U,定容至25μL。扩增程序:95 °C预变性3min,变性94 °C 30s,退火57 °C 40s,延伸72 °C 40s,共35个循环,72 °C延伸 7min。
第二轮PCR扩增:以第一轮PCR扩增的产物为模板,用量为1μL,依次加入10× RCR buffer2.5μL、dNTPs(10mmol/L)2μL、同源和互补引物(表1)各0.5μL、 rTaq DNA聚合酶 1U,定容至25μL。扩增程序:扩增程序同上。
扩增结束后,取6μL PCR产物和1μL 6× Loading buffer 在1.2%的琼脂糖凝胶中进行分离,染色后在BIO-RAD凝胶成像系统中观察扩增结果。
1.2.4 扩增产物的鉴定
将巢式PCR扩增的目的片段切胶回收,连接 pMD18-T 载体,4℃过夜,转化感受态菌株。37℃培养12h,挑取单菌落进行PCR验证,挑选阳性克隆送北京诺赛基因公司进行测序。获得的序列采用DNAMAN等软件进行分析,在NCBI数据库进行BLAST比对。
1.2.5 巢式PCR扩增条件的优化
引物用量(10mmol/L):对二扩引物GVA-F2/R2的用量分别设置0.1μL、0.3μL、0.5μL的浓度梯度;
退火温度:巢式引物均设定了55℃、57℃、59℃、61℃的温度梯度。
1.2.6 巢式引物灵敏度的测定
测定提取总RNA的浓度,用蒸馏水进行稀释,梯度分别为:100、10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8。
2 结果与分析
2.1 巢式引物的特异性
利用巢式引物对GVA阳性的葡萄样品分别进行PCR扩增,结果表明,巢式组合GVA-F1/R1-GVA-F2/R2能扩增出清晰的目标条带。测序结果表明,所获得的序列(登录号MH350849)为GVA的序列。其中,GVA-F2/R2扩增的片段在GVA基因组的位置为6654-6874 nt(参考基因组DQ855082)。
2.2 巢式PCR扩增条件的优化

引物用量(10 mmol/L):引物GVA-F2/R2在设置的三个浓度下均能扩增出目标条带,条带的亮度随引物浓度的降低而降低,且引物的利用比较充分,均无引物二聚体出现。用量为0.1μL和0.5μL时,有非特异性扩增(图1)。
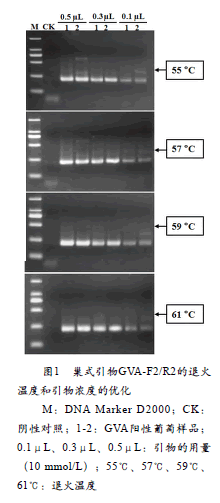
退火温度:巢式引物在所设置的4个退火温度下均能正常扩增,且随着温度的提高引物的非特异性扩增随之减少(图1)。
综
合以上两个因素的电泳结果,引物GVA-F2/R2的用量(10mmol/L)为0.3μL,退火温度为59℃或61℃时,扩增效果最佳。
2.3 巢式引物的灵敏度
样品总RNA的 A260 /A280 平均值为 2.06,平均浓度为 107. 77ng /μL。以稀释后的RNA为模板,用引物GVA-F1/ R1进行一扩,然后分别取1μL扩增产物作为二扩的模板进行扩增,结果显示,模板浓度稀释至10-7,巢式引物GVA-F2/R2仍能扩增出目标条带。
2.4 巢式PCR扩增体系的应用
对随机收集的60份葡萄样品中的GVA进行普通的RT-PCR及巢式RT-PCR检测,结果表明,两种病毒巢式扩增的检出率均较普通扩增的高,其中,巢式扩增中GVA的检出率为23.3%(14/60),比单一引物GVA-F1/R1(10.0%)和GVA-F2/R2(8.3%)的检测率均提高1倍多。
3 讨论
PCR技术具有高度敏感、特异、快速和简便等多种优点,但是检测结果易受引物特异性、病毒序列多样性以及检测材料类型等的影响。相较于常规RT-PCR,巢式RT-PCR具有更高的检测灵敏度和特异性,被广泛运用于葡萄病毒的检测。本研究建立了一种快速、灵敏,且检测效率高的巢式RT-PCR检测体系,显著提高了GVA的检测效率。