病毒病防控岗位
周俊 范旭东 任芳 董雅凤
葡萄扇叶病毒(Grapevine fanleafvirus, GFLV)可引起葡萄扇叶病,是全世界范围内危害葡萄最为严重的病毒之一。葡萄扇叶病可导致葡萄产量10%~80%的损失,引起葡萄浆果中糖含量降低和可滴定酸度下降,并且缩短葡萄园的生产寿命。GFLV属线传多面体病毒属(Nepovirus)病毒,自然传毒介体为标准剑线虫(Xiphinema index)和意大利剑线虫(X. italiae)。带毒的繁殖材料和苗木是GFLV传播的主要途径。GFLV基因组包括两条单链正义RNA,主要编码一些与复制有关的蛋白,RNA2编码RNA2复制必需的归巢蛋白(2AHP),以及移动蛋白(2BMP)和外壳蛋白(2CCP)。
虽然已经报道了指示植物、血清学、分子生物学等多种GFLV检测方法,但由于不同程度地存在检测周期长、灵敏度不高、稳定性较差、无法定量分析等缺点,近来有多位研究者开展了高灵敏度可定量的GFLV实时荧光定量RT-PCR检测方法。由于中国GFLV分离物与其他国家分离物基因序列存在明显差异,因此,针对中国GFLV分离物建立快速灵敏并可相对定量的实时荧光定量RT-PCR检测方法十分必要。我们根据葡萄扇叶病毒(Grapevine fanleaf virus,GFLV)RNA2 序列设计 4 对特异性引物,通过引物筛选、体系优化,建立了以 FL-HP1-F/R 为引物的 GFLV 的SYBR GreenⅠ实时荧光定量 RTPCR方法。该方法标准曲线循环阈值与模板浓度呈良好的线性关系,扩增效率为 100%,相关性系数为 0.998,灵敏性分别是常规 RTPCR和巢式 RT-PCR 的 100 倍和10倍。重复性试验表明组内和组间变异系数均小于 2.59%,显示该方法具有较好的检测稳定性。利用建立的荧光定量方法测定 12 个葡萄样品中 GFLV 含量,并检测 58 个葡萄样品,结果表明不同葡萄样品中GFLV 含量差异较大,最高含量是最低含量的 81 245.5 倍,与 ELISA和巢式 RT-PCR 相比,实时荧光定量方法能检测出更多的 GFLV 分离物。
1 试剂
2× Sybr Green qPCR Mix、pTOPO-TA Vector购自北京艾德莱生物有限公司;实时荧光定量PCR 8连管购自生工生物工程上海股份有限公司;PrimeScriptTMRTreagent Kit with gDNA Eraser、PCR Fragment Recovery Kit和感受态细胞DH5α购自大连宝生物公司(TaKaRa),M-MLV逆转录酶购自普洛麦格(Promega)公司;10×PCR 缓冲液(含20mmolμL-1Mg+)、Taq酶、dNTPs购自北京鼎国昌盛生物技术有限公司;DNase/RNase Free dH2O购自北京天根生化科技有限公司;DNA Mark-D 购自Sangon;Real-Time PCR ThermalCycler为德国Analytikjena公司生产的qTOWER 2.0 型。
2 总RNA提取及反转录
取葡萄休眠枝条韧皮部100mg,采用吸附柱法进行总RNA提取。琼脂凝胶电泳检测RNA完整性,并在–80℃下保存备用。SYBRGreen qPCR去除基因组DNA反转录(PrimeScriptTMRT reagent Kit withgDNA Eraser,TaKaRa):取5×gDNA Eraser buffer 2.0 μL,gDNAEraser 1.0 μL,总RNA 1.0 μL混匀,42.0 ℃ 2 min;加入以下混合液:PrimeScript RT Enzyme Mix Ⅰ1.0 μL,RT Primer Mix 1.0 μL,5× PrimeScript buffer 2 4.0 μL,RNase Free dH2O 4.0 μL;37 ℃ 15min,85 ℃ 5 s,–20 ℃保存备用。
3 引物
根据本实验室扩增得到的GFLV的RNA2基因序列, 利用Oligo 7软件设计的特异性引物FLHP1F/R,其中:扩增片段大小为228bp,用NCBI的Primer-BLAST进行比对,以保证引物的特异性。所有引物均由Sangon合成。
4 反应条件
荧光定量RT-PCR 在qTOWER2.0 Thermal Cycler(Analytikjena,德国) 上进行, 采用试剂盒为2×Sybr Green qPCR Mix(艾德莱,北京,中国)。反应体系含2×SYBR GreenⅠ的qPCR Mix12.5μL、10μmol•L-1正反向引物0.5μL、DNase/RNase Free dH2O9.5μL和cDNA 2μl,每个反应总体积为25μL,使用0.2ml 实时荧光定量RT-PCR 8连管(Sangon)进行。荧光定量PCR扩增条件:95 ℃预变性30 s,95℃ 15s,退火温度 15s,72℃ 20s,40个循环,在延伸步骤记录荧光信号;PCR扩增产物的熔解曲线分析的温度范围从60~95℃,其中每6s增加温度0.5℃,以鉴别引物二聚体和非特异性扩增。
5 检测效果
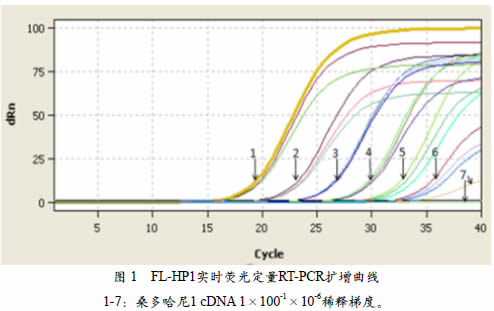
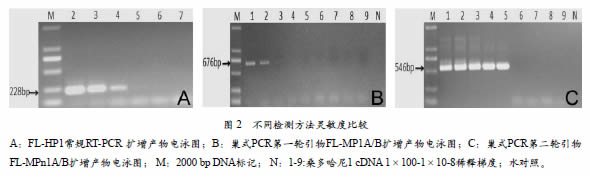
实时荧光定量RT-PCR、常规RT-PCR和巢式RT-PCR灵敏度测试结果表明,FL-HP1实时荧光定量RT-PCR能够检测到稀释梯度为10-5 cDNA(图1),而常规RT-PCR只能检测10-3cDNA(图2,A),这表明实时荧光定量RT-PCR检测灵敏度比常规RT-PCR检测提高了100 倍。此外,巢式PCR第一轮引物FL-MP1A/B只能检测到1×10-1的cDNA(图2,B),而巢式PCR第二轮引物FL-MPn1A/B能检测到1×10-4的cDNA(图2,C),这表明实时荧光定量PCR检测灵敏度分别是巢式PCR第一、二 轮检测10000倍和10倍。