病毒病防控岗位
周俊 范旭东 董雅凤 张尊平
葡萄扇叶病毒(Grapevine fanleafvirus, GFLV)是葡萄扇叶病病原,可导致葡萄产量降低、品质下降,抗逆性减弱。目前,常用ELISA和RT-PCR两种方法对GFLV进行快速检测,我们在研究过程中,发现上述2种方法的检测结果存在一定差异,尤其是RT-PCR方法的检出率过低。为了改善和提高GFLV分子检测的灵敏度和可靠性,本团队研究建立了巢式RT-PCR检测方法,经验证,该方法检测灵敏度高,稳定可靠,可应用于田间葡萄样品和脱毒葡萄样品中GFLV的快速检测。
1 巢式PCR检测用引物

根据GenBank已公布的GFLV常见株系移动蛋白(MP ) 和外壳蛋白(CP ) 基因序列的保守区,设计8条用于GFLV巢式PCR扩增的简并引物(FL-MP1A、FLMP1B、FL-MPn1A、FL-MPn1B、FL-CP1A、FL-CP1B、FL-CPn1A、FL-CPn1B)。其中,FL-MP1A/B、FL-MPn1A/B引物扩增GFLV2AMP基因,扩增大小分别为676、546bp;FL-CP1A/B、FL-CPn1A/B扩增GFLV 2ACP基因,扩增大小分别为669、446bp,引物由上海生工生物工程技术服务有限公司合成。
2 总RNA提取
采用柱式方法提取RNA,具体步骤如下:取约50mg葡萄组织与1mL 裂解液研磨释放RNA匀浆;匀浆离心后,取上清液600μL与300μL的无水乙醇混合,加入吸附柱中(购自北京艾德莱生物科技有限公司);经多次漂洗后,用50μL无RNA酶的水洗脱总RNA;取5μL总RNA进行琼脂糖凝胶电泳,合格的总RNA溶液立即用于反转录或者保存于-70℃超低温冰箱中备用。
3 反转录PCR
逆转录在1.5mL灭菌离心管中进行,依次加入灭菌纯水9.0μL、6bp随机引物(上海生工生物工程技术服务公司合成)1.0μL、总RNA 5.0μL后,离心混匀95℃水浴5min,冰上放置5min。再依次加入5×M-MLV Buffer 5.0μL、2.5mmol/L dNTPs 3μL、200 U/μL M-MLV 0.5μL、灭菌纯水1.5μL,37℃ 水浴10min,42℃水浴50min,72℃水浴5min,合成的cDNA立即进行PCR扩增或-20℃保存备用。巢式PCR第一轮反应体系为25μL:10×Taq buffer 2.5μL,dNTPs(2.5mmol/L) 2.0μL,10mol/L引物1 0.5 μL,10 mol/L引物2 0.5 μL,DEPC水17.25μL,5U/μL Taq 0.25μL,cDNA 2μL;巢式第二轮PCR将Taq将量降为0.15μL,cDNA量降为1μL,减少的量用DEPC水补足。PCR反应条件为:94℃预变性5min;94℃变性30s,54℃复性30s,72℃延伸1min,共35个循环;最后一轮循环后72℃延伸10min。
4 扩增产物克隆与测序
PCR反应结束后,取产物5μL于1 . 5%的琼脂糖凝胶1 2 0V进行电泳,EB染色后在凝胶成像仪下观察。PCR扩增获得的目的DNA片段采用北京艾德PCR FragmentRecovery Kit回收纯化,取4μL回收产物与pMD18-T试剂盒中的pMD18-T 1μL和Solution 4μL混匀后,于16℃连接1h即可用于转化大肠杆菌DH5α感受态细胞中。经蓝白斑筛选,挑取白色菌落进行菌液培养,通过PCR鉴定获得的阳性重组质粒,随机选择其中3-6个阳性克隆子由北京诺赛基因组研究中心进行测序,以证实扩增产物为GFLV特异片段。
5 检测结果
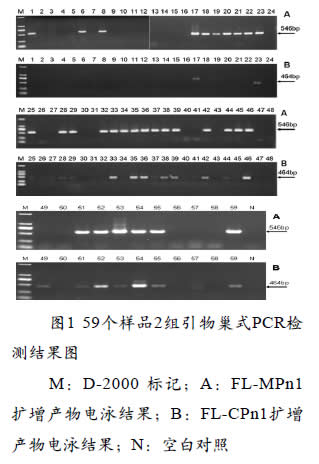
利用这两套引物分别对59个样品进行检测,结果FLMP1、FLCP1仅17和53号样品有目的条带,而FLMPn1、FLCPn1分别检出30和21个样品有目的条带;FLMPn1、FLCPn1 检出样品中共有19个样品一致,均为阳性,该检测结果说明本实验建立的巢式RT-PCR检测方法是可靠的,且引物FLMPn1的检测结果更好,不仅检出样品较多,而且扩增目的条带也较引物FLCPn1清晰(图1)。